ISO 14971: Aplicación de la Gestión de Riesgos a los Dispositivos Médicos
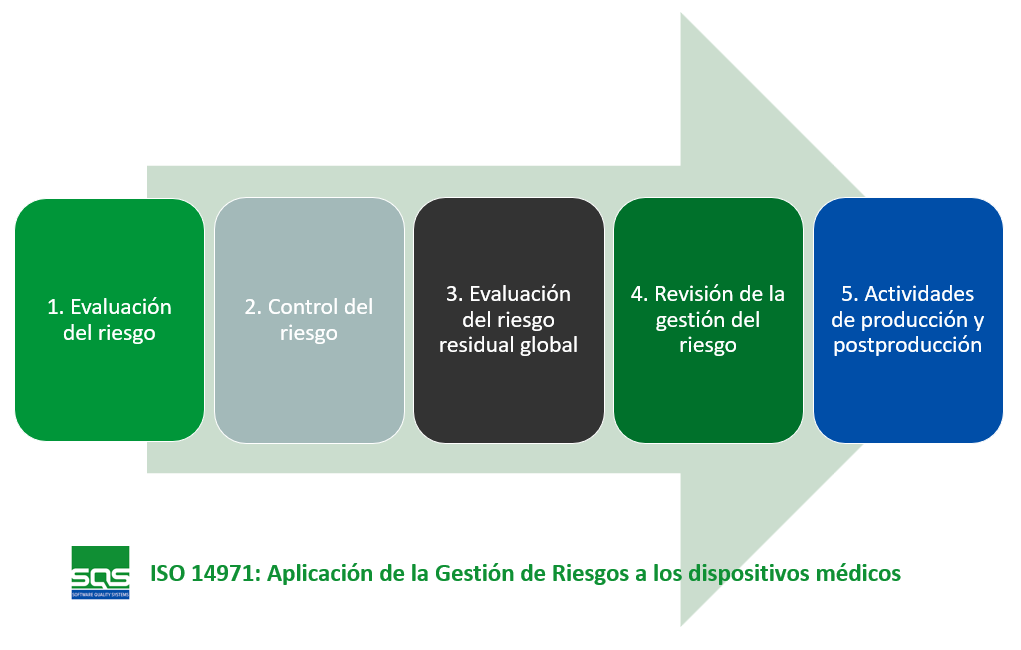 ISO 14971 es la norma de referencia para la gestión de riesgos en productos sanitarios y software como dispositivo médico. Su edición vigente, ISO 14971:2019, describe la terminología, los principios y un proceso sistemático que abarca todo el ciclo de vida del producto, desde la concepción hasta la vigilancia poscomercialización. El objetivo es asegurar que los fabricantes identifiquen los peligros, estimen y evalúen los riesgos asociados, y apliquen controles eficaces para reducirlos a niveles aceptables, siempre ponderando los beneficios clínicos frente a los posibles daños para pacientes, usuarios y terceros.
ISO 14971 es la norma de referencia para la gestión de riesgos en productos sanitarios y software como dispositivo médico. Su edición vigente, ISO 14971:2019, describe la terminología, los principios y un proceso sistemático que abarca todo el ciclo de vida del producto, desde la concepción hasta la vigilancia poscomercialización. El objetivo es asegurar que los fabricantes identifiquen los peligros, estimen y evalúen los riesgos asociados, y apliquen controles eficaces para reducirlos a niveles aceptables, siempre ponderando los beneficios clínicos frente a los posibles daños para pacientes, usuarios y terceros.
El corazón de la norma se plasma en un flujo de trabajo iterativo: definir el contexto de uso, llevar a cabo el análisis de peligros, estimar la probabilidad y la gravedad, evaluar la aceptabilidad, implementar controles (por diseño, protecciones o información) y, finalmente, verificar su eficacia. ISO 14971 exige también la gestión de datos de producción y posproducción para capturar incidentes reales y retroalimentar el expediente de riesgos, reforzando así la mejora continua.
Desde el punto de vista regulatorio, ISO 14971 se integra con los Sistemas de Gestión de la Calidad (ISO 13485) y se ha armonizado con la normativa europea: EN ISO 14971:2019 + A11:2021 proporciona presunción de conformidad con los Reglamentos MDR (UE) 2017/745 e IVDR 2017/746, reemplazando definitivamente la versión 2012 bajo las antiguas directivas. Fuera de Europa, la FDA incluye la norma en su nueva QMSR como vía para demostrar la aplicación de principios de gestión de riesgos en EE. UU., reforzando la convergencia global.
Adoptar ISO 14971 no solo cumple un requisito legal, sino que aporta ventajas competitivas: reduce reclamaciones, acorta tiempos de certificación y facilita la entrada en mercados exigentes. El ecosistema digital—desde software como dispositivo médico hasta sistemas basados en IA—hace que la cultura de “risk-based thinking” sea aún más crítica. Para profundizar, el informe técnico ISO/TR 24971:2020 detalla ejemplos prácticos y vínculos con estándares complementarios.
Contacta con un experto
Si quieres saber más del tema o tienes cualquier otro tipo de consulta, no lo dudes, ponte en contacto con nosotros.
Solicita más información
Síguenos
Aviso Legal | Política de Cookies | Contacto
© 2026 Software Quality Systems S.A. | SQS is a member company of Innovalia





