IEC 62304: Proceso del ciclo de vida del software dispositivo médico
Se trata de un estándar de seguridad funcional que cubre tanto el diseño como el mantenimiento seguros de software de dispositivos médicos. Proporciona procesos, actividades y tareas para garantizar la seguridad.
¿Cuándo?
- El software es en sí mismo un dispositivo médico
- El software es una parte integrada del dispositivo médico final
En la siguiente imagen se pueden observar todas las actividades que cubre esta normativa:
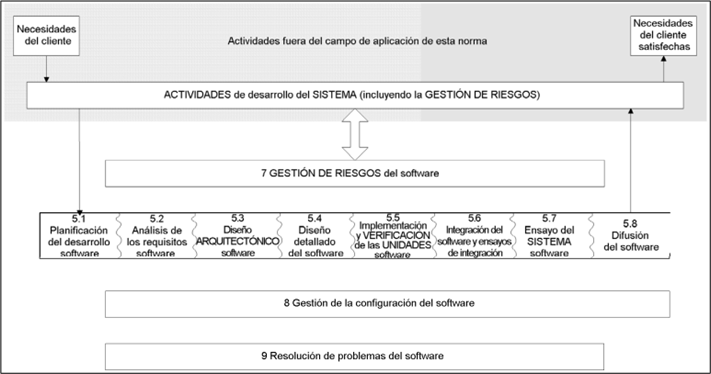
Las actividades en esta normativa se dividen en función del riesgo del producto. La normativa 62304 tiene su propia clasificación en función del riesgo del dispositivo médico:
- A: No es posible lesión o daño para la salud
- B: Es posible lesión no-seria
- C: Es posible muerte o lesión seria
Actividades durante el desarrollo del software
A continuación nos centramos en las actividades del desarrollo del software en sí.
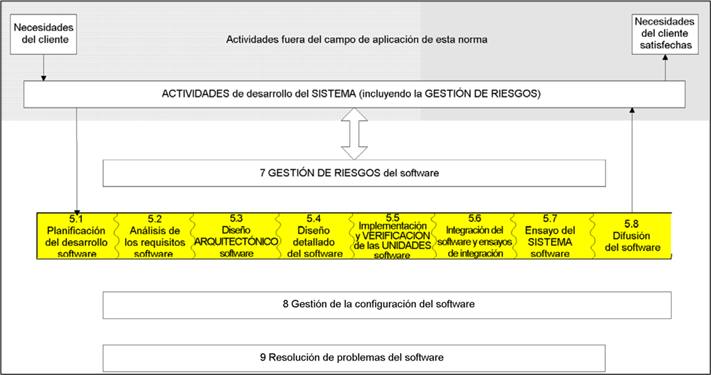
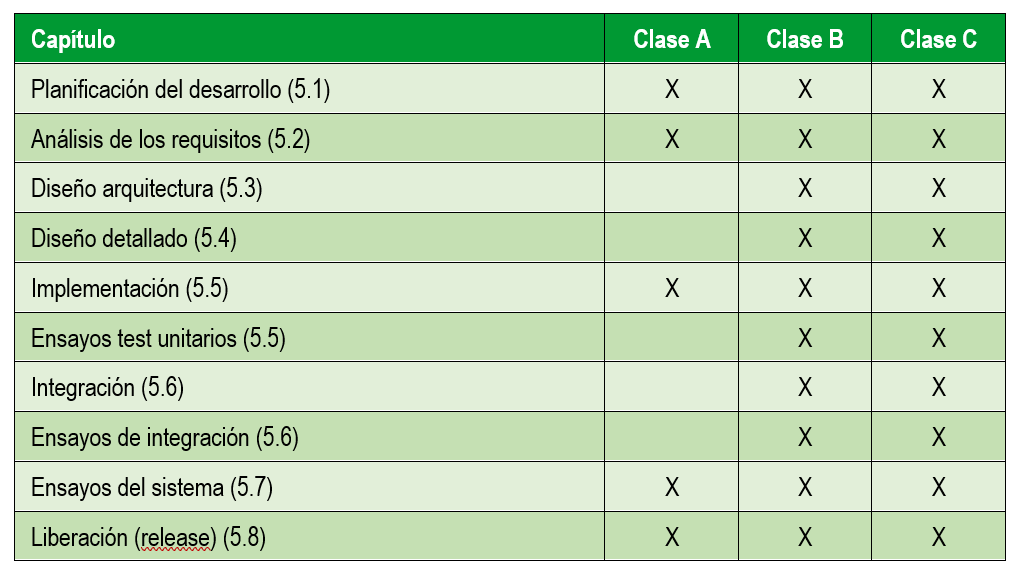
En la siguiente tabla se resumen las actividades que se realizan en función del riesgo del dispositivo médico:
En la siguiente imagen se resumen las actividades de desarrollo y validación software recogidas en el modelo en V:
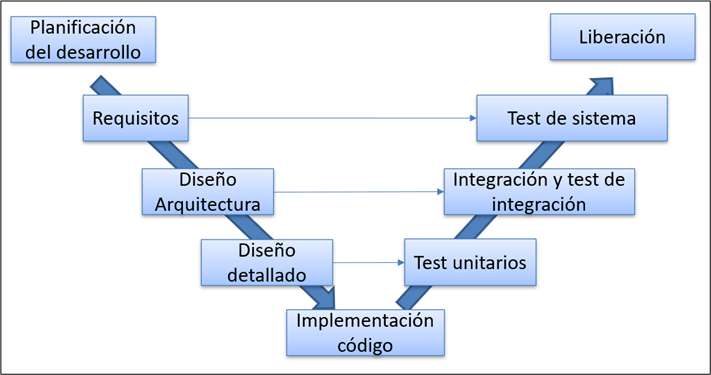
Se puede observar que para un nivel de riesgo bajo las actividades a realizar son bastante menores a las clases superiores. También existen diferencias entre las clases de riesgo B y C dentro de cada capítulo de la norma.
Contacta con un experto
Si quieres saber más del tema o tienes cualquier otro tipo de consulta, no lo dudes, ponte en contacto con nosotros.
Solicita más información
Aviso Legal | Política de Cookies | Contacto
© 2026 Software Quality Systems S.A. | SQS is a member company of Innovalia





