EN 62366-1 Aplicación de la ingeniería de usabilidad a los productos sanitarios
Esta normativa también es de las que ya estaba entre las normas armonizadas en las directivas antiguas.
- Especifica un proceso para que un fabricante analice, especifique, desarrolle y evalúe la usabilidad de un dispositivo médico en lo que respecta a la seguridad.
- Este proceso de ingeniería de usabilidad permite al fabricante evaluar y mitigar los riesgos asociados con el uso correcto y los errores de uso, es decir, uso normal.
- Se puede utilizar para identificar riesgos, pero no evalúa ni mitiga los riesgos asociados con el uso anormal.
- Este proceso se realiza en paralelo al proceso de gestión de riesgos.
Un resumen del alcance de esta normativa se presenta en la siguiente imagen:
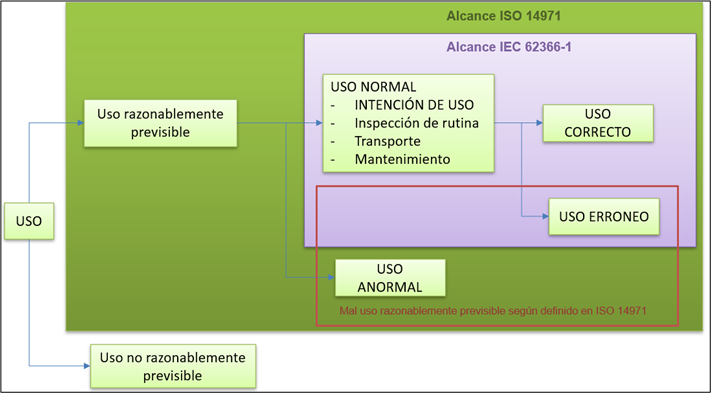
Como se puede observar, el alcance de la normativa de usabilidad 62366-1 se refiere al uso normal de nuestro dispositivo médico software.
El resumen de actividades a realizar son las siguientes:
- Plan de ingeniería de usabilidad
- Datos de entrada de usabilidad
- Preparación especificación de uso
- Análisis
- Diseño y evaluación formativa
- Evaluación sumativa
Contacta con un experto
Si quieres saber más del tema o tienes cualquier otro tipo de consulta, no lo dudes, ponte en contacto con nosotros.
Solicita más información
Síguenos
Aviso Legal | Política de Cookies | Contacto
© 2026 Software Quality Systems S.A. | SQS is a member company of Innovalia





